Instituto de Tecnología Química (UPV-CSIC)
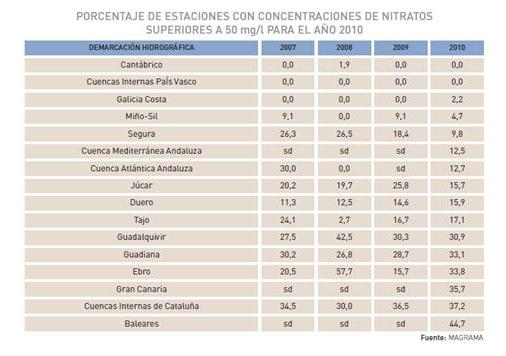
Los nitratos son iones formados por tres átomos de oxígeno, uno de nitrógeno y con una carga negativa (NO3-), no tienen color ni sabor y se encuentran en la naturaleza disueltos en el agua. Su presencia natural en las aguas superficiales o subterráneas es consecuencia del ciclo natural del nitrógeno, sin embargo, en determinadas zonas ha habido una alteración de este ciclo en el sentido de que se ha producido un aumento en la concentración de nitratos, debido fundamentalmente a un excesivo uso de abonos nitrogenados y a su posterior arrastre por las aguas de lluvia o riegos. Actualmente en la Comunidad Europea el nivel máximo permitido de nitratos en aguas potables es de 50 mg/l, siendo 25 mg/l el valor guía. Sin embargo existe un número importante de estaciones de captación de agua en las que se superan estos valores, especialmente en Baleares, Canarias y la cuenca interna de Cataluña.
Porcentaje de estaciones con concentraciones de nitratos superiores a 50 mg/l para el año 2010
Los nitratos pueden ser producidos tanto por fuentes naturales como antropogénicas, siendo estas últimas las responsables del importante aumento en su concentración observado en los últimos años. Así, los residuos industriales constituyen una fuente importante de nitratos en las aguas, siendo las industrias más contaminantes los mataderos, destilerías, azucareras, industrias de levadura, de almidón, textiles y fertilizantes. Sin embargo, estas emisiones suelen estar bastante controladas y son muy puntuales. Más preocupante es, en la actualidad, la contaminación por nitratos provenientes de la agricultura y ganadería intensiva. En las zonas donde se practica una agricultura intensiva se utilizan enormes cantidades de abonos químicos, a los que se suman los abonos naturales que provienen de los excrementos animales. Estos abonos suelen contener una cantidad importante de compuestos nitrogenados, como los nitratos, que en proporciones adecuadas mejoran el crecimiento de las plantaciones y aumentan su rendimiento. Sin embargo, cuando estos compuestos se encuentran en cantidades demasiado altas para que sean absorbidos por las plantas, se infiltran a través del suelo y alcanzan las aguas subterráneas, contaminando pozos y acuíferos. Análogamente, los excrementos procedentes de animales de granjas también aumentan la concentración de nitratos en el suelo, de donde pueden pasar a los acuíferos que hay bajo ellos.
Los efectos nocivos de los nitratos sobre la salud humana, aunque se conocen desde la mitad del siglo XX, no están totalmente claros. Así, en 1945 Comly relacionó la cianosis (falta de oxígeno en la sangre) de los niños, de 33 a 27 días de edad, con los nitratos del agua de un pozo, lo que dio pie a que se abriese una larga controversia sobre la toxicidad de los mismos en el organismo. De hecho los nitratos como tales no son tóxicos, incluso a dosis considerables, ya que son eliminados por el riñón. El problema es que en el organismo, especialmente en personas con problemas gástricos o en niños de menos de tres meses, el nitrato puede reducirse a nitrito, el cual se absorbe en los glóbulos rojos de la sangre, oxidando el hierro de la hemoglobina a metahemoglobina, disminuyendo la capacidad de los glóbulos rojos para transportar oxígeno. Asimismo, algún tipo de cáncer del tracto gastrointestinal ha sido atribuido a la acción de compuestos nitrosos, formados en el interior del organismo a partir de los nitritos, los que a su vez proceden de la reducción de los nitratos consumidos con el agua. Es por ello que para que un acuífero sirva de abastecimiento a una población es obligatorio que contenga menos de 50 mg/l de NO3- y si los contiene, éstos deben ser eliminados antes de que el agua llegue al consumidor.
En la actualidad existen varias técnicas para la eliminación de los nitratos en las aguas. Estas se pueden clasificar en dos grupos:
- Las técnicas de separación, como su nombre indica, pretenden separar los nitratos de la corriente de agua a depurar, concentrándolos en un segundo desecho (la salmuera) que habría que tratar o almacenar en un depósito. Estas técnicas son: la electrodiálisis, la ósmosis inversa y las resinas aniónicas.
- Las técnicas de transformación pretenden transformar los nitratos en otros compuestos químicos inocuos por medio de vías biológicas o catalíticas
Las primeras son las más utilizadas en la actualidad para el tratamiento de aguas naturales contaminadas por nitratos y aunque dan muy buenos resultados son caras y no resuelven el problema pues no transforman el nitrato en un compuesto inofensivo, sino que generan una salmuera concentrada en nitratos, sin ningún valor económico y que hay que tratar o almacenar adecuadamente.
Respecto a las técnicas de transformación, los procesos biológicos se suelen utilizar actualmente en el tratamiento de las aguas residuales e industriales y se incorporan a muchas depuradoras, dando resultados muy satisfactorios. No obstante esta tecnología, aunque es adecuada para aguas residuales, no se puede utilizar para potabilizar aguas por la posible contaminación bacteriana del agua tratada y por la presencia de residuos orgánicos tras el tratamiento del agua. 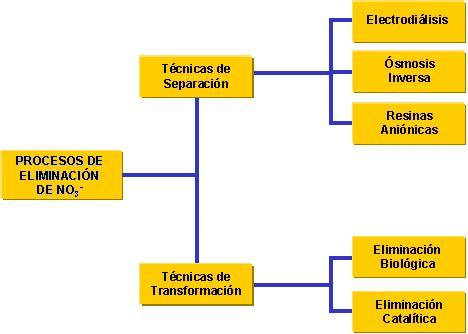
Procesos de eliminación de NO3-
Una nueva técnica de transformación es la basada en procesos catalíticos, más adecuada desde el punto de vista medioambiental y que permitiría depurar un agua contaminada por nitratos sin generar residuos. Esta técnica se basa en la reducción catalítica de los nitratos a nitrógeno. En este proceso el nitrato es transformado en una sustancia inerte como el nitrógeno (que constituye alrededor del 78% del aire) y no se debe generar ningún subproducto que deba ser tratado. Esta técnica comenzó a desarrollarse a partir de 1989, con el descubrimiento de la actividad del catalizador bimetálico de cobre-paladio en la reducción de los nitratos de aguas naturales. En este proceso los nitratos son reducidos por el hidrógeno en presencia de un catalizador sólido y se transforman en nitrógeno y agua a temperatura ambiente. El problema es que además de que el paladio es un metal caro, durante la reacción se observó que se podían producir sustancias nocivas como los nitritos y el amonio, por lo que este catalizador no podía ser utilizado a nivel comercial hasta resolver este problema. No obstante, aunque esta técnica aún no es comercial, se está estudiando como alternativa a las técnicas tradicionales de separación.